
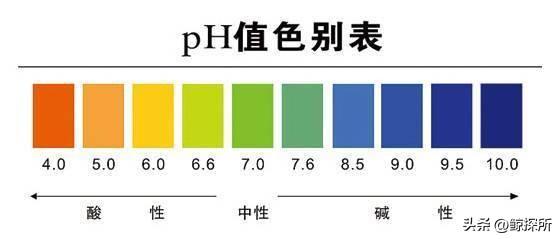
pH值与溶液中氢离子(H+)浓度的量度是怎么计算的
在化学中,pH值是用来表示溶液酸度或碱度的基本参数,它是溶液中氢离子(H+)浓度的量度。
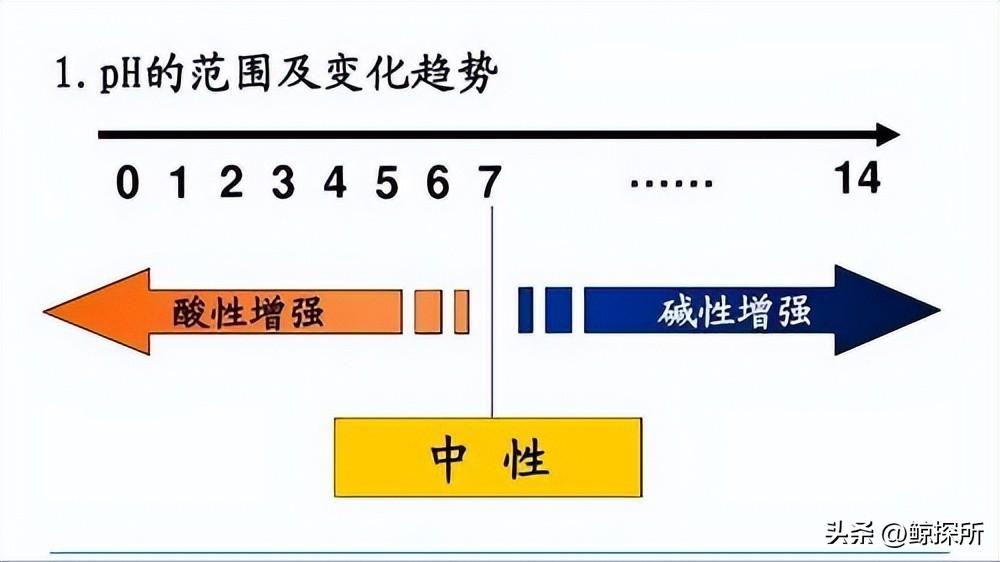
pH值范围从0到14,7代表中性,低于7表示酸性,高于7表示碱性,虽然计算纯水或简单酸或碱溶液的pH值相对简单,但测定盐溶液的pH值需要更细致的方法。

当强酸和强碱反应时,形成盐溶液,导致中性盐和水的形成,盐在水中的离解导致阳离子和阴离子的存在,每一种都可能影响溶液的pH值,为了计算盐溶液的pH值,我们需要考虑阳离子和阴离子的水解反应。
质子守恒原理是基于这样一个事实,即盐溶液中阳离子水解过程中产生的质子总数必须等于阴离子水解过程中消耗的质子总数,这个原理允许我们根据形成盐的酸和碱的相对强度来确定溶液是酸性、碱性还是中性。
与阴离子水解产生的OH-离子相比,当盐溶液的阳离子水解产生过量的H+离子时,所得溶液是酸性的,当阳离子来自弱碱,而阴离子来自强酸时,就会发生这种情况。
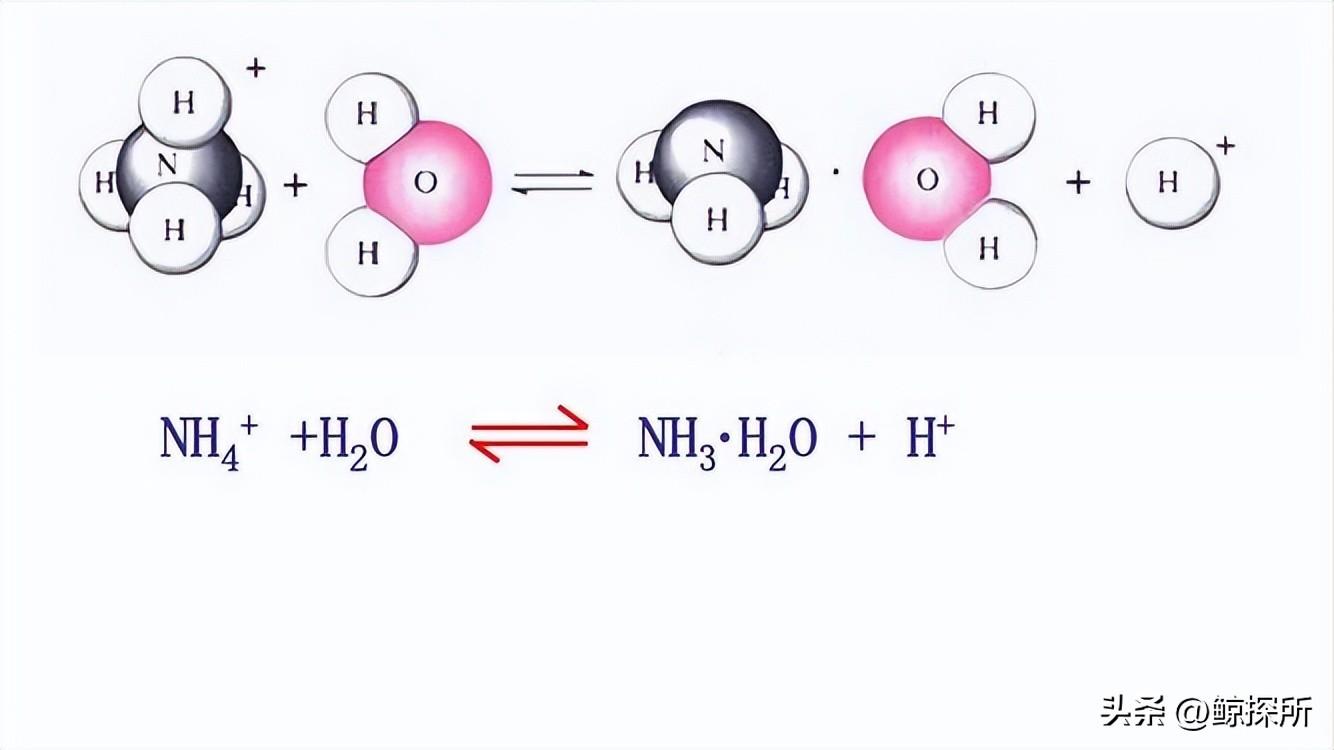
例如,让我们考虑氯化铵(NH4Cl)盐,NH4+的水解导致H+离子的释放,使溶液呈酸性,水解反应的方程式可以表示如下:
NH4+(水溶液)+ H2O(水溶液)↔ NH3(水溶液)+ H3O+(水溶液),由于水解反应产生H3O+离子,溶液中H+离子的浓度增加,降低了pH值。

相反,当盐溶液的阴离子水解产生的OH-离子多于阳离子水解产生的H+离子时,所得溶液是碱性的,当阴离子来自弱酸,而阳离子来自强碱时,就会发生这种情况。
例如,让我们考虑醋酸钠盐(CH3COONa),CH3COO-的水解导致OH-离子的释放,使溶液呈碱性,水解反应的方程式可以表示如下:
CH3COOH(水溶液)+ OH-(水溶液),由于水解反应产生OH-离子,溶液中OH-离子的浓度增加,pH值升高。
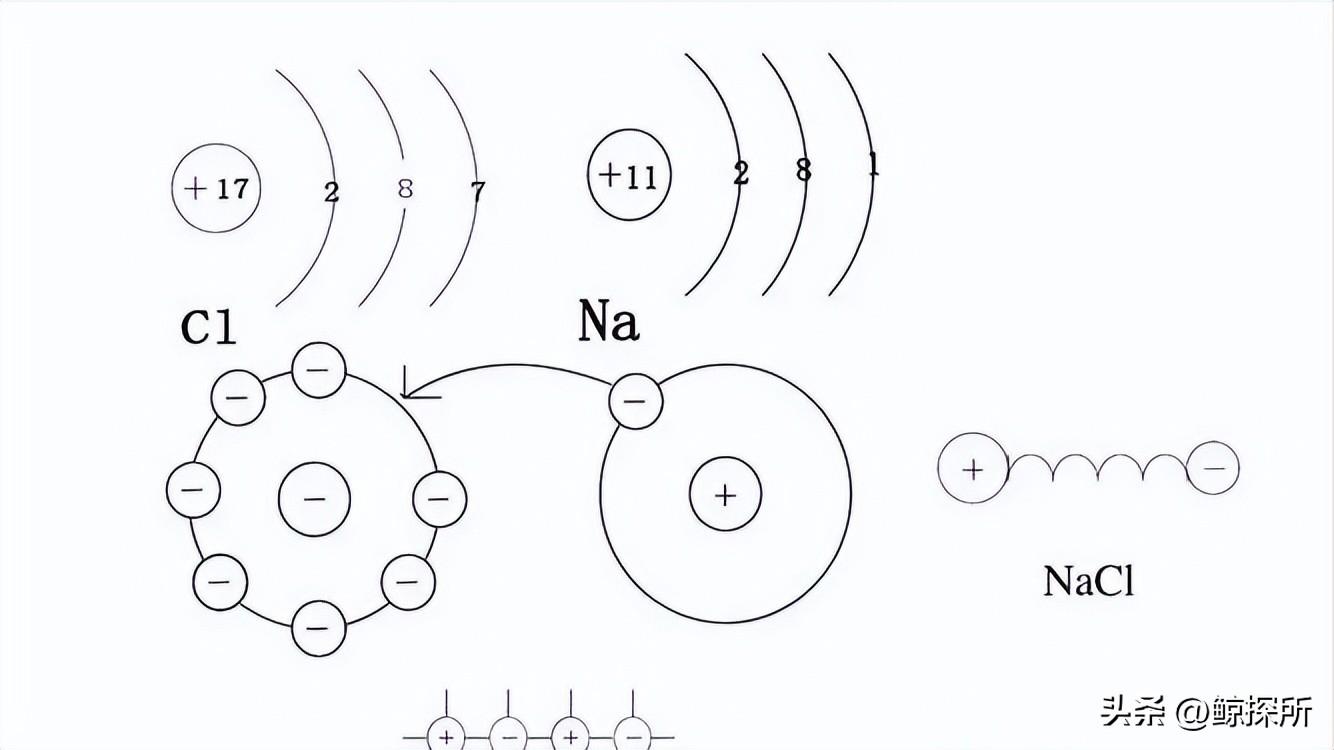
在某些情况下,盐溶液中的阳离子和阴离子可能发生类似的水解反应,导致形成等量的H+和OH-离子,这导致中性pH值,一个例子是氯化钠(NaCl),Na+和Cl-离子都不会发生明显的水解,导致溶液中H+和OH-离子达到平衡。
计算盐的pH值解决方案,我们可以遵循循序渐进的方法:
识别盐溶液的阳离子和阴离子,确定每个离子是来自弱酸还是弱碱。
写出阳离子和阴离子的平衡水解方程式,这一步包括考虑离子与水的反应,并确定形成的产物,使用质子守恒原理确定H+和OH-离子的相对产量。
根据水解反应评估H+和OH-离子的浓度,通过比较这些离子的浓度来确定溶液是酸性、碱性还是中性。
利用H+离子的浓度计算pH值,回想一下,pH被定义为H+离子浓度的负对数(以10为底)。

让我们将这个方法应用到一个具体的例子中:
例如:溴化钙(CaBr2)。
第一步:阳离子是Ca2+(来自强碱),阴离子是Br-(来自强酸)。
第二步:Ca2+的水解反应可以写成:Ca2+(AQ)+2h2o(l)↔ca(oh)2(AQ)+2h+(AQ)。
Br-的水解反应不会显著发生。
第三步:由于Ca2+水解产生H+离子,H+离子的浓度会高于OH-离子,因此,溶液是酸性的。
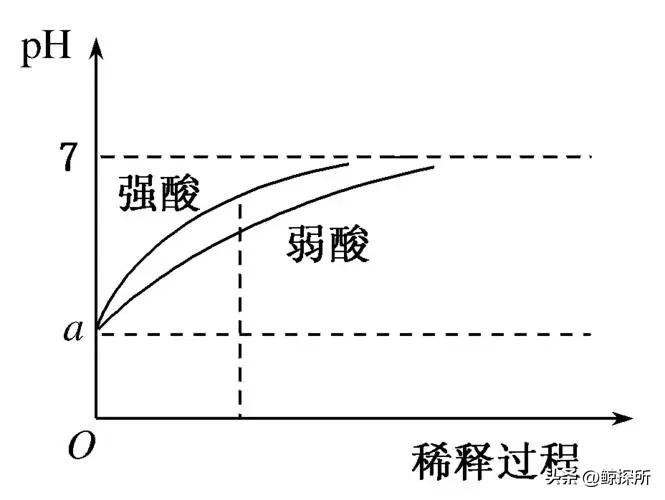
第四步:为了计算pH值,我们需要确定H+离子的浓度,这可以通过考虑盐的浓度和水解程度来实现,然而,如果盐的浓度相对较低,水解反应可能不会显著影响pH值,在这种情况下,我们可以假设水解产生的H+离子的贡献可以忽略不计,pH值将由水本身的离解决定。
总之,使用质子守恒计算盐溶液的pH值包括考虑阳离子和阴离子的水解反应,通过应用质子守恒原理并比较H+和OH-离子的相对浓度,我们可以确定溶液是酸性、碱性还是中性,然后可以根据H+离子的浓度计算pH值,请记住,具体的计算将取决于盐的性质及其水解反应。
让我们探索另一个场景,例如:醋酸铵(NH4C2H3O2)。
第一步:阳离子是NH4+(来自弱碱氨),阴离子是C2H3O2-(来自弱酸乙酸)。
第二步:NH4+的水解反应可以写成:NH4+(AQ)+H2O(l)↔NH3(AQ)+h3o+(AQ)。
C2H3O2-的水解反应可以写成:c2h3o 2-(AQ)+H2O(l)↔hc2h3o 2(AQ)+oh-(AQ)。
第三步:比较水解反应,我们可以看到NH4+水解产生H3O+离子,而C2H3O2-水解产生OH-离子,这表明溶液中OH-离子的浓度将高于H+离子的浓度,所以,解决办法是基本的。
第四步:为了计算pH值,我们需要确定OH-离子的浓度,由于溶液是碱性的,我们可以用OH-离子的浓度来计算pOH,从14中减去pOH可以得到pH值,即pH + pOH = 14,或者,我们可以将pOH转换为OH-离子浓度,然后确定pOH,最后,从14中减去pOH将得到pH值。
重要的是要注意,在某些情况下,水解反应可以是不完全反应或平衡反应,水解的程度可以根据浓度和温度等因素而变化,因此,具有复杂水解反应的盐溶液的pH值计算可能需要额外的考虑,例如平衡常数和浓度计算。
计算盐溶液的pH值需要了解质子守恒以及阳离子和阴离子的水解反应,通过应用质子守恒原理并比较H+和OH-离子的相对浓度,我们可以确定溶液是酸性、碱性还是中性,然后可以使用适当的公式或原理,基于H+或OH-离子的浓度计算pH值。
考虑盐的性质是至关重要的,包括所涉及的酸和碱的强度,以及可能影响水解反应的任何平衡因素或其他因素,通过遵循这些步骤并考虑盐溶液的具体特性,我们可以准确地确定其pH值。
虽然使用质子守恒计算盐溶液pH值的方法提供了一个有用的框架,但必须考虑可能影响水解反应并进而影响pH值的其他因素。
浓度:盐溶液的浓度可以显著影响水解的程度,更高的浓度可以促进更显著的水解,导致对pH值更显著的影响。
温度:水解反应依赖于温度,在某些情况下,提高温度可以增强水解,从而对pH值产生更大的影响。
酸性和碱性强度:用于形成盐的酸或碱的强度起着至关重要的作用,强酸和强碱通常不会发生明显的水解,而弱酸或弱碱会导致更明显的水解反应。
离子强度:溶液的离子强度受其他离子的影响,可以影响水解反应,高离子强度可以降低水解程度并改变pH值。
络合离子形成:一些离子可能与水分子形成络合物种,影响水解过程和pH值,这些络合离子可以影响溶液中H+和OH-离子的平衡。
平衡常数:水解反应可被视为平衡过程,平衡常数(Kw、Ka和Kb)在确定pH值时起着重要作用,这些常数提供了有关水解程度以及H+和OH-离子相对浓度的信息。
两性离子:某些离子,如HCO3-和HPO42-,既可以作为酸,也可以作为碱,它们的水解反应涉及质子的转移,这使得盐溶液中pH值的测定更加复杂。
在计算盐溶液的pH值时,考虑这些因素及其对水解反应的具体影响是很重要的,实验数据、平衡常数和热力学原理可用于改进计算并提供更精确的结果。
使用质子守恒作为框架计算盐溶液的pH值是确定溶液酸度或碱度的有价值的工具,通过考虑阳离子和阴离子的水解反应,我们可以根据H+和OH-离子的相对浓度确定溶液是酸性、碱性还是中性。
然而,考虑其他因素是至关重要的,如浓度、温度、酸碱强度、离子强度、络合离子形成、平衡常数和两性离子的存在,将这些因素纳入分析可确保更准确地计算盐溶液的pH值。
了解利用质子守恒计算盐溶液pH值的方法,在科学和工业的各个领域都有实际应用,这里有几个例子。
环境科学:pH值在决定自然水体的酸碱度方面起着至关重要的作用,盐溶液,例如由矿物质溶解在水中形成的盐溶液,可以显著影响河流、湖泊和海洋的pH值,通过计算这些盐溶液的pH值,科学家可以监测和评估人类活动对水生生态系统的影响。
农业:盐溶液通常在农业中用作肥料,这些溶液的pH值会影响植物的生长和养分的有效性,通过了解盐溶液的pH值,农民可以对使用的肥料类型和浓度做出明智的决定,确保作物生产的最佳条件。
当处理包含多个离子或具有两性性质的离子的复杂盐时,使用质子守恒计算盐溶液的pH值的方法变得更具挑战性,在这种情况下,水解反应和pH值计算可能会更加复杂。
络合盐可能同时发生涉及多种阳离子和阴离子的水解反应,与离子相关的酸和碱的相对强度将决定水解程度和最终的pH值,在这些情况下,考虑平衡常数及其相互作用变得至关重要。
例如,让我们考虑硫酸铝盐(Al2(SO4)3),在这种情况下,阳离子Al3+和阴离子SO42-都可以进行水解反应,Al3+的水解反应可以写成:
Al3+(水溶液)+ 3H2O(水溶液)↔氢氧化铝+ 3H+(水溶液)
SO42-的水解反应可以写成:
硫酸根离子(水溶液)+2h2o(↔硫酸根离子(水溶液)+ 2OH-(水溶液)
这种复杂盐溶液的pH值计算需要同时考虑两种水解反应,需要考虑这些反应的平衡常数以及盐溶液的浓度,以准确确定pH值。
此外,一些盐可能包含具有两性特性的离子,这意味着它们既可以充当酸,也可以充当碱,例如,碳酸氢根离子(HCO3-)可以根据反应条件接受或提供质子,在这种情况下,水解反应会更加复杂,既涉及OH-离子的形成,又涉及H+离子的消耗。
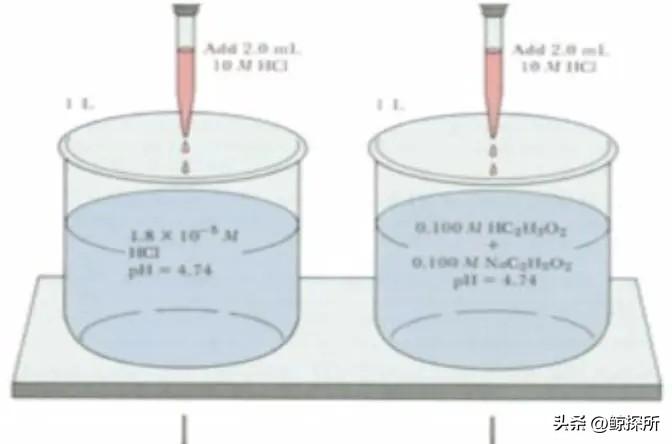
为了准确计算复杂盐溶液的pH值,考虑所有相关的水解反应、平衡常数和溶液浓度非常重要,在这些情况下,可能需要先进的理论模型和实验测量来获得精确的pH值。
计算复杂盐溶液的pH值需要仔细考虑多重水解反应及其平衡常数,多种离子或具有两性性质的离子的存在使pH计算过程变得复杂。
在这种情况下,先进的理论模型、实验测量和平衡原理的考虑成为确定精确pH值的必要条件,了解水解反应及其相互作用使研究人员和科学家能够深入了解复杂盐溶液的行为和性质,促进包括化学、环境科学和材料科学在内的各个领域的进步。










网站内容来自网络,如有侵权请联系我们,立即删除!
Copyright © 屯百科 琼ICP备2023011085号-1