
电解池是将什么能转化为什么能 ?
学习目标
1.从宏观和微观的角度理解电解池中电子的移动、阴阳离子的移动、阴阳两极上的反应及其 变化、电流形成的过程和原理。
2.建立对电解过程的系统分析认识的思维模型,理解电解的规律,会判断电解的产物,会书 写电解的电极反应式和总反应式。
3.通过对氯碱工业、电镀、电解精炼铜、电冶金等原理的分析,认识电能与化学能之间的能 量转化。
4.建立电解应用问题的分析思维模型和电解相关计算的思维模型,加深对电解原理的理解和 应用
知识导学
知识点 1 电解原理
1.实验探究:电解 CuCl2溶液
(1)按下图所示装置完成实验,并填写下表。
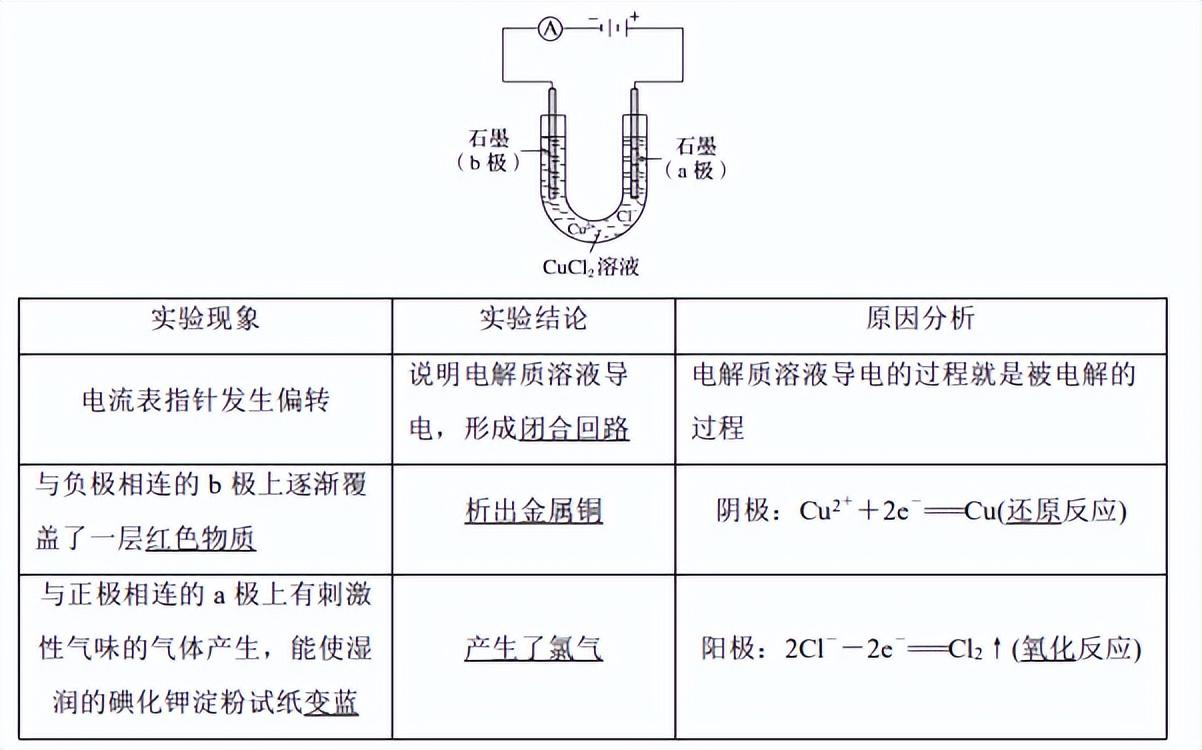
2.电解和电解池
(1)电解:使电流通过电解质溶液(或熔融电解质)而在阳极、阴极引起氧化还原反应的过程。
(2)电解池:将电能转化为化学能的装置(也称电解槽)。
(3)电解池的构成条件 ①直流电源;②两个电极;③电解质溶液或熔融电解质;④形成闭合回路。
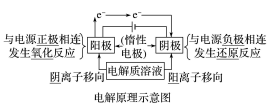
3.电解原理
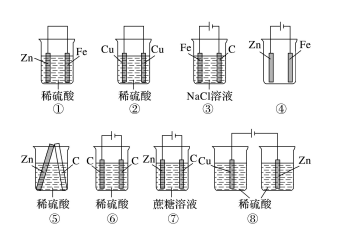
例 1.如下图所示装置中属于电解池的是________(填序号)。
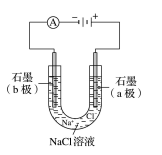
例 2.如图所示是电解稀盐酸的装置,其中 c、d 为石墨电极。试回答下列问题
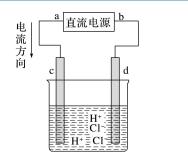
(1)a 电极为________,b 电极为________。
(2)c 电极为________,电极反应式为________________________,发生了________反应。 d 电极为________,电极反应式为________________________,发生了________反应。
(3)电解过程中,氢离子向____(填“阴”或“阳”,下同)极移动,氯离子向____极移动。电 解总方程式为:________________________。
电解池阴极和阳极的判断依据
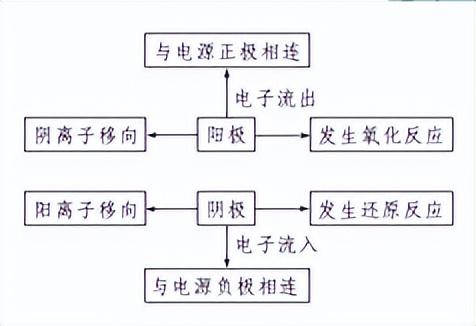
知识点 2 电解规律
1.电解池的分析方法与规律
(1)判断阴、阳极,分析阳极材料是惰性电极还是活泼电极。
(2)分析电解质水溶液的全部离子并分为阴、阳两组。
(3)根据放电顺序写出电极反应式 ①阴极(与电极材料无关):
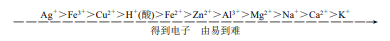
②阳极(与电极材料有关):

(4)总化学方程式或离子方程式 书写反应的总离子方程式时,要注意:若参与电极反应的 H + (或 OH - )是由水电离出来的, 应用水的分子式表示。
提醒 ①“活泼电极”一般指 Pt、Au 以外的金属。
②最常用的放电顺序:阳极:活泼金属>Cl->OH -;阴极:Ag+>Fe 3+>Cu 2+>H +。
2.电解后溶液的复原规律 用惰性电极电解下列酸、碱、盐溶液,请填写下表:
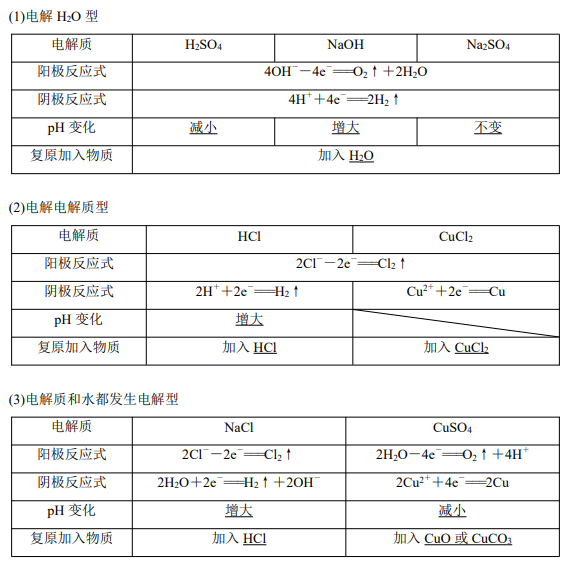
特别提醒 电解后溶液的复原,从溶液中放出的气体和生成的沉淀,按照原子个数比组成具 体物质再加入溶液即可。遵循“少什么加什么,少多少加多少”的原则。
例 1.用石墨作电极电解 0.1 mol·L -1的 CuSO4溶液,当有 0.4 mol 电子通过电路时,发现阴 极增重 6.4 g,则要使电解后的溶液恢复到电解前状态,则可向电解后的溶液中加入( ) A.0.1 mol Cu(OH)2 B.0.1 mol CuO C.0.2 mol CuO D.0.1 mol CuO 和 0.2 mol H2O
例 2.用如图所示的装置进行电解。通电后发现湿润的淀粉KI 试纸的 C 端变为蓝色
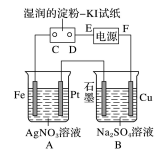
(1)E 为电源的____极,F 为电源的____极。
(2)A 中发生反应的化学方程式为
_____________________________________________。
(3)在 B 中观察到的现象是
________________________________________________。
(4)D 端的电极反应式为
_________________________________________________。
知识点 3 电解饱和食盐水 烧碱、氯
气都是重要的化工原料,习惯上把电解饱和食盐水的工业生产叫做氯碱工业。
1.电解饱和食盐水的原理
通电前:溶液中的离子是 Na+、Cl-、H +、OH -。 通电后:
①移向阳极的离子是 Cl-、OH -,Cl-比 OH -容易失去电子,被氧化成氯气。 阳极:2Cl--2e-===Cl2↑(氧化反应)。
②移向阴极的离子是 Na+、H +,H +比 Na+容易得到电子,被还原成氢气。其中 H +是由水电 离产生的。 阴极:2H2O+2e-===H2↑+2OH - (还原反应)。
③总反应: 化学方程式为
离子方程式为 2Cl-+2H2O===== 电解 H2↑+Cl2↑+
2.氯碱工业生产流程 工业生产中,电解饱和食盐水的反应在离子交换膜电解槽中进行。
①阳离子交换膜电解槽
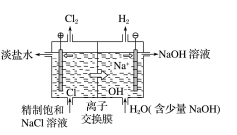
②阳离子交换膜的作用:只允许 Na+等阳离子通过,不允许 Cl-、OH -等阴离子及气体分子 通过,可以防止阴极产生的氢气与阳极产生的氯气混合发生爆炸,也能避免氯气与阴极产生 的氢氧化钠反应而影响氢氧化钠的产量。
3.氯碱工业产品及其应用 (1)氯碱工业产品主要有 NaOH、Cl2、H2、盐酸、含氯漂白剂。 (2)电解饱和食盐水为原理的氯碱工业产品在有机合成、造纸、玻璃、肥皂、纺织、印染、 农药、金属冶炼等领域中广泛应用。
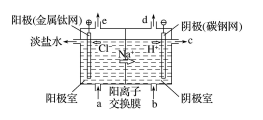
例 1.氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列 化工产品,如图是离子交换膜法电解饱和食盐水的示意图,图中阳离子交换膜只允许 Na+ 等通过,不允许 OH-,Cl-等阴离子及气体分子通过。
试完成下列问题:
(1)阳极(金属钛网)电极反应式:
______________________________________________; 阴极(碳钢网)电极反应式:
__________________________________________________; 电解饱和食盐水总离子方程式:
_____________________________________________。
(2)阳离子交换膜的作用为:
________________________________________________, 从图中 b位置补充的为含有少量 NaOH的水,NaOH 的作用为______________________。
(3)精制饱和食盐水从图中________位置(填“a”“b”“c”或“d”,下同)补充,NaOH 溶 液从图中________位置流出,图中 e 位置排出的气体为________。
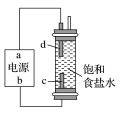
例 2.在新冠肺炎疫情期间,“84”消毒液是环境消毒液之一。某学生想制作一种家用环保 型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使 Cl2被完全吸收制得有 较强杀菌能力的消毒液,设计了如图所示的装置。c、d 都为碳电极
完成下列填空:
(1)a 为电源的________极,c 为电解池的________极(填“正”“负”或“阴”“阳”)。
(2)d 电极上发生的电极反应式:____________________,电解产生消毒液的总化学方程式为
___________________________________________________________________
知识点 4 电镀 电冶金
1.电镀与电解精炼 电镀是一种利用电解原理在某些金属表面镀上一薄层其他金属或合金的加工工艺。电镀的主 要目的是使金属增强抗腐蚀能力,增加表面硬度和美观。
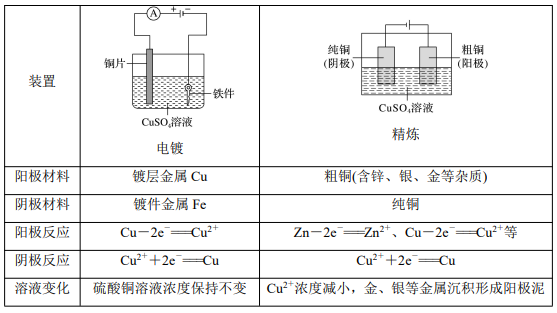
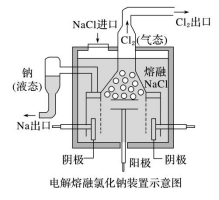
2.电冶金 (1)金属冶炼的本质:使矿石中的金属离子获得电子变成金属单质的过程。如 Mn++ne-===M。 (2)电解法用于冶炼较活泼的金属(如钾、钠、镁、铝等),但不能电解其盐溶液,应电解其熔 融态。 如:电解熔融的氯化钠可制取金属钠的反应式: 阳极:2Cl--2e-===Cl2↑; 阴极:2Na++2e-===2Na; 总反应:2NaCl(熔融)===== 电解 2Na+Cl2↑










网站内容来自网络,如有侵权请联系我们,立即删除!
Copyright © 屯百科 琼ICP备2023011085号-1